市民公開講座 - 2023年 11月開催(東京・オンライン)
講演 1
1.肺がん治療のこれまでの流れと今後への期待

善家 義貴 先生
国立がん研究センター東病院 呼吸器内科 医長
薬物療法の目的によって重視するポイントは異なる
肺がんの薬物療法には、大きく2つの目的があります。まずはがんの再発、再燃を予防するために使用するもので、術後補助療法、放射線治療がこれにあたります1)。もう1つはがんの進行を遅らせるために使用するもので、進行肺がんに対する分子標的薬や免疫チェックポイント阻害薬などによる治療がこれにあたります2)。
根治を目指した再発、再燃予防のための薬物療法では、抗がん剤(化学療法)の投与期間を設定し、副作用をコントロールしながら適切な投与量でその期間継続することが大事です。一方、進行肺がんの場合は、できるだけ自分の生活の質を保ちながらなるべく元気で長生きすることが目標となるので、投与量や投与間隔も患者さんごとに副作用と効果のバランスをみて調整しつつ、薬剤を変更しながら続けていくことが大切になります。いずれの目的のためにも、副作用の管理が重要であることがわかります。
分子標的薬は特定の遺伝子異常を狙った薬
がんの薬物療法としては、殺細胞性の抗がん剤が長く使われてきました。これはがん細胞そのものを直接攻撃する薬剤ですが、正常細胞とがん細胞を見分けて攻撃するわけではないため、人間の重要な臓器も傷つけてしまうことがあります。
そこで、がんの薬物療法の有効性と安全性をより高めることを目指し、分子標的薬が開発されました。遺伝子研究の進歩の過程で、遺伝子の異常ががん化につながることがわかり、がん化する遺伝子もいくつか特定されました。たとえば、日本人の肺腺がんでは上皮成長因子受容体(EGFR)と呼ばれる遺伝子の異常が約半数で認められます3)。異常を引き起こす遺伝子はドライバー遺伝子と呼ばれ、EGFR以外にもKRAS、ALK、ROS1、RET、HER2などが特定されており、それらで肺腺がん全体の約7割を占めます3)。それらをターゲットとするのが分子標的薬であり、さまざまなドライバー遺伝子の異常に対応する治療薬もすでに開発(保険承認)されています。まずは異常をきたしたドライバー遺伝子を特定し、それに対する分子標的薬を最初に使うことが現在の標準治療になっています4)。
分子標的薬に特徴的な副作用がある
分子標的薬により肺がん治療の成績に一定の進展はみられましたが、その後ドライバー遺伝子の特定がさらに進み、その数が非常に増えたため、遺伝子検査もより複雑になりました。そうした中、次世代シークエンサーと呼ばれる先端的な装置を用いた検査法が確立され、現在はさまざまな遺伝子を一度に調べられるようになっています。
なお、遺伝子検査ではがんが疑われる組織を気管支鏡で採取しなければなりません。気管支鏡は気管にファイバースコープを通すのでどうしても苦しさはあるのですが、この検査をおこなわなければ遺伝子の異常を調べられないため、とても大事な検査であることをご理解いただきたいと思います。
分子標的薬にも副作用はあります。個々の分子標的薬に特徴的な副作用があり、たとえばEGFRの阻害薬ではかゆみを伴うにきび、肌の乾燥、爪や鼻粘膜の炎症、口内炎、下痢、肝臓の機能の低下のほか、間質性肺炎といった重篤な副作用のリスクもあります3)。必ず主治医の先生と相談をしつつ、副作用とうまく付き合いながら治療を続けることが大切です。
免疫チェックポイント阻害薬は我々が持っている免疫を再活性化する
比較的あたらしい治療薬としては、免疫チェックポイント阻害薬があります。人間の身体の中では、健康な人でも1日に5,000個以上の細胞ががん化しているといわれています。それでもがんがなかなか増殖しないのは、Tリンパ球という体内の免疫ががん細胞の発生を認識し、速やかにそれを排除する仕組みがあるからです。
ところが、がんは非常に賢く、自分はがん細胞ではなく正常な細胞だと思わせるシグナルを出し、Tリンパ球を出動させないようにして、静かに増殖していく能力もあることがわかってきました。たとえば、自分は正常だ、仲間だと知らせるシグナルとして、PD-1およびPD-L1と呼ばれるたんぱく質が見つかっています。
免疫チェックポイント阻害薬は、このPD-1やPD-L1の働きを抑え、再びTリンパ球が活動し始めるようにする治療薬です。すなわち、免疫チェックポイント阻害薬は我々が生まれながらに持っている免疫を再活性化する薬剤なのです。ただし、PD-L1というタンパク質ががん細胞にたくさん認められる患者さんでPD-1抗体やPD-L1抗体の有効性が高いと報告されています2)。
免疫チェックポイント阻害薬の副作用の原因は免疫の過剰な働き
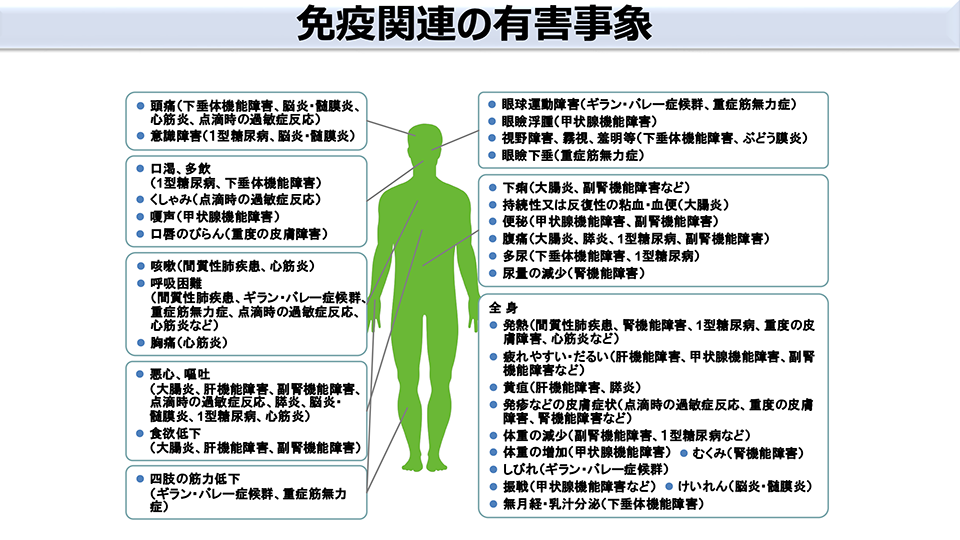
免疫チェックポイント阻害薬の特徴として、投与開始後しばらくは一般的な抗がん剤治療と効果にそれほど違いはありませんが、最終的にはより高い効果が長く続いていくことが確認されています5)。免疫チェックポイント阻害薬は私たちの身体に備わっている免疫を活用する仕組みであるため、その免疫が一度がんを認識するとそれをずっと覚えていて、がんを抑制する仕組みが長く維持されていくのではないかと考えられます。しかし、免疫チェックポイント阻害薬にも有害事象が報告されています(図1)6)。免疫チェックポイント阻害薬によって元々備わっているTリンパ球が元気になり過ぎることで、Tリンパ球の過剰な働きが正常な臓器も傷つけ、自己免疫疾患に類似した問題が起きる可能性があるのです。こういった症状は個人差が大きく、いつ、どのような症状が起こるか予測が難しいとされていますが、治療中断とならないためにも有害事象を常に念頭に置く必要はあります。
図1
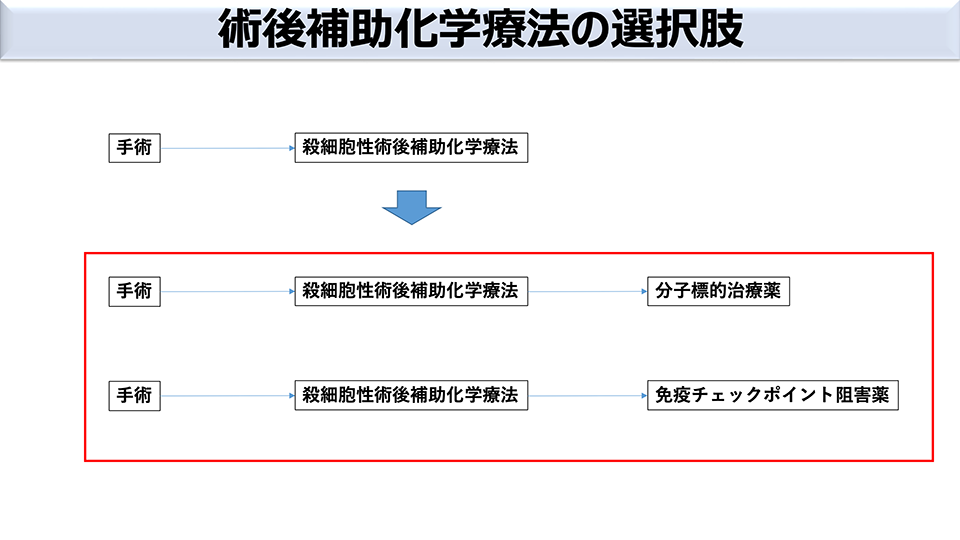
肺がんの術後補助療法の内容も変化
これまでは、術後補助療法として抗がん剤治療がおこなわれてきました。近年では、手術後にまず抗がん剤治療をおこない、そのあとに分子標的治療をおこなうこともあります。これは、手術後に遺伝子異常が特定できた患者さんの選択肢です。さらに手術後の抗がん剤治療のあとに、PD-L1の発現状況に応じて免疫チェックポイント阻害薬による治療をおこなうことも選択肢に加えられました。(図2)4)。
ただし、術後補助療法は強制ではないので、我々医師は術後補助療法の意義を患者さんによく説明し、受けるか受けないかを必ず確認しています。
図2
患者さん個人にあった最適な治療を提案、選択
以上のように、肺がんの治療体系は非常に複雑化してきました。そこで、患者さんと主治医が十分に話し合いながら治療の方向性を決めていく、シェアード・ディシジョンメイキング(SDM:共同意思決定)の重要性が提唱されています。
患者さんと医師とでは、持っている情報や感じ方が異なります。そこで、医師としては必要な情報を提供し、患者さんが最適な意思決定をするお手伝いができたらと考えています。患者さんもぜひ担当の先生方に、体調や希望、不安なことなどを伝えてみていただければと思います。
- 文献
- 1)国立がん研究センターがん情報サービス
- 2)日本肺癌学会編:患者さんと家族のための肺がんガイドブック2023年版, 金原出版株式会社
- 3)Kohno T, et al. Transl Lung Cancer Res. 2015; 4(2): 156-164.
- 4)日本肺癌学会編:肺癌診療ガイドライン2023年版, 金原出版株式会社
- 5)Ferrara R, et al.: J. Thorac. Dis. 2018; 10(Suppl 13): S1564-S1580.
- 6)厚生労働省「免疫チェックポイント阻害薬による免疫関連有害事象対策マニュアル」(2022年2月)
2023年11月19日市民公開講座当時の内容です。
2025年5月掲載